テムセル全例調査概要
 テムセル®HS注については、「造血幹細胞移植後の急性移植片対宿主病」を効能、効果又は性能として平成27年9月18日に承認されました。
テムセル®HS注については、「造血幹細胞移植後の急性移植片対宿主病」を効能、効果又は性能として平成27年9月18日に承認されました。
承認にあたっては、再審査期間中は、本品を使用する症例全例を対象として使用成績調査を実施することが義務付けられました。(参考資料1)
これに基づいた、テムセル®HS注 使用成績調査(全例調査)のデータ収集において、
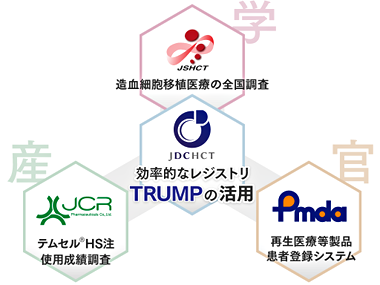
日本造血細胞移植データセンターおよび日本造血細胞移植学会が実施する「造血細胞移植医療の全国調査」の造血細胞移植登録一元管理プログラム(TRUMP)を用いることとなりました。
(参考資料1, 2)
さらに、本品は、国内で承認された最初の再生医療等製品でもあります。
再生医療等製品の使用状況およびその安全性情報を適切に把握するための体制を構築するために、
国(厚生労働省, MHLW、独立行政法人 医薬品医療機器総合機構, PMDA)では再生医療等製品レジストリを構築することを決定しましたが、
本品に関しては、この役割を日本造血細胞移植データセンターおよび日本造血細胞移植学会が実施する「造血細胞移植医療の全国調査」にて担うこととなりました。
(PMDA 「再生医療等製品安全対策の新たな事業・調査」ページ)
「テムセル®HS注 使用成績調査(全例調査)実施計画書(参考資料2)」に基づいた、使用成績調査に関する解析は実施計画書に従って遂行され、
再審査のために使用されるとともに、今後の開発のためなどに利用されます。
その他、研究目的での利用を含み、研究者、学会等、あるいは行政などがテムセル全例調査での収集データを利用する場合においては、
「造血細胞移植医療の全国調査」における利活用申請方法に則り申請され、目的と利用範囲を踏まえ案件ごとにJDCHCT内のデータ管理を担う委員会等で審議されます。
参考資料1: テムセル®HS注 通知
参考資料2: テムセル®HS注 使用成績調査(全例調査)実施計画書 -概要-
調査項目
- テムセル全例調査対応 CRF (ダウンロードいただくには、JDCHCT HPのWeb認証が必要です。)